安全で安価な医薬品"ジェネリック医薬品"
「ジェネリック医薬品」という名称は、欧米の多くのジェネリック医薬品が含有されている有効成分の一般的名称(Generic name)を冠して販売名をつけていることに由来しています。日本では、薬事行政上の公文書では「先発医薬品」に対する「後発医薬品」という名称を使用しています。
まずは“ジェネリック医薬品”とはどういうものなのかを知って頂き、皆様の生活の中で役立てて頂けると幸いです。
まずは“ジェネリック医薬品”とはどういうものなのかを知って頂き、皆様の生活の中で役立てて頂けると幸いです。
有効成分や効き目は新薬と同じ。
国で定められた承認審査基準をクリアしている安全な薬です。
製造販売の承認を得るためには、品質、有効性、安全性が先発医薬品と同等であることを証明する必要があります。
先発医薬品とジェネリック医薬品とが同レベルの品質、有効性、安全性を有するかどうかについて厳格な審査を行い、品質、有効性、安全性が同レべルにあることが確認されたジェネリック医薬品だけが製造販売承認を得ることができます。
規格及び試験方法
●ジェネリック医薬品は、先発医薬品と有効成分の含有量、不純物の程度、溶出の程度(内用固形製剤の場合)などが同レベルでなければなりません。
●同レベルであるとことを保証するために、有効成分の確認試験、含量規格、純度試験(不純物、類縁物質等)、溶出試験(内用固形製剤の場合)などを3ロット、3回の試験結果から設定し、その試験結果を提出する必要があります。
●規格値には、ジェネリック医薬品、先発医薬品とも安全域を加味して一定の幅が設定されています。
安全性試験
●ジェネリック医薬品の安定性は先発医薬品と同レベルでなければなりません。
●同レベルであるとこを保証するために、最終包装された状態で、通常の保存条件よりも厳しいレベルで6ヶ月間保存し、有効成分の含有量や不純物の程度などが「規格及び試験方法」の範囲内であることが必要です。
●上記のことより、通常の保存条件下で3年間安定であることが推測されています。
生物学的同等性試験
●ガイドライン・同等性判定基準
ジェネリック医薬品は、ヒトでの有効性と安全性が先発医薬品と同レベルでなければなりません。日本のガイドラインの特徴の一つは、経口製剤試験法の中に溶出試験が組み入れられていることです。これにより、製剤設計の段階で、胃酸度の違いによる非同等な製剤が臨床に供される危険性がより少なくなるようにデザインされています。 全身作用を期待しない局所投与製剤などでは、原則として、皮膚薬物動態学的試験、効力を裏付ける薬理作用、又は治療効果を比較する臨床試験で同等性が試験されます。
●被験者
試験は、同一被験者に一定の間隔を置いて、ジェネリック医薬品と標準製剤(先発医薬品)を交互に投与するクロスオーバー法で、同一被験者内での両剤の差がより明確に検出される条件下にて実施されます。 なお、これらの試験は、治験ですので、新薬の治験の場合と同様、GCP(「医薬品の臨床試験の実施に関する基準」)に適合しなければなりません。
●試験製剤
試験に使用した製剤と市販製剤との間にバイオアベイラビリティの差があるという危険性を無くすために、生物学的同等性試験に供される試験製剤は、実生産ロットの1/10以上のサイズで製造された製剤を使用することと規定されています。
先発医薬品とジェネリック医薬品とが同レベルの品質、有効性、安全性を有するかどうかについて厳格な審査を行い、品質、有効性、安全性が同レべルにあることが確認されたジェネリック医薬品だけが製造販売承認を得ることができます。
規格及び試験方法
●ジェネリック医薬品は、先発医薬品と有効成分の含有量、不純物の程度、溶出の程度(内用固形製剤の場合)などが同レベルでなければなりません。
●同レベルであるとことを保証するために、有効成分の確認試験、含量規格、純度試験(不純物、類縁物質等)、溶出試験(内用固形製剤の場合)などを3ロット、3回の試験結果から設定し、その試験結果を提出する必要があります。
●規格値には、ジェネリック医薬品、先発医薬品とも安全域を加味して一定の幅が設定されています。
安全性試験
●ジェネリック医薬品の安定性は先発医薬品と同レベルでなければなりません。
●同レベルであるとこを保証するために、最終包装された状態で、通常の保存条件よりも厳しいレベルで6ヶ月間保存し、有効成分の含有量や不純物の程度などが「規格及び試験方法」の範囲内であることが必要です。
●上記のことより、通常の保存条件下で3年間安定であることが推測されています。
生物学的同等性試験
●ガイドライン・同等性判定基準
ジェネリック医薬品は、ヒトでの有効性と安全性が先発医薬品と同レベルでなければなりません。日本のガイドラインの特徴の一つは、経口製剤試験法の中に溶出試験が組み入れられていることです。これにより、製剤設計の段階で、胃酸度の違いによる非同等な製剤が臨床に供される危険性がより少なくなるようにデザインされています。 全身作用を期待しない局所投与製剤などでは、原則として、皮膚薬物動態学的試験、効力を裏付ける薬理作用、又は治療効果を比較する臨床試験で同等性が試験されます。
●被験者
試験は、同一被験者に一定の間隔を置いて、ジェネリック医薬品と標準製剤(先発医薬品)を交互に投与するクロスオーバー法で、同一被験者内での両剤の差がより明確に検出される条件下にて実施されます。 なお、これらの試験は、治験ですので、新薬の治験の場合と同様、GCP(「医薬品の臨床試験の実施に関する基準」)に適合しなければなりません。
●試験製剤
試験に使用した製剤と市販製剤との間にバイオアベイラビリティの差があるという危険性を無くすために、生物学的同等性試験に供される試験製剤は、実生産ロットの1/10以上のサイズで製造された製剤を使用することと規定されています。
Point:有効成分・効き目は新薬と同じ。国で定められた基準をクリアした安心の薬。
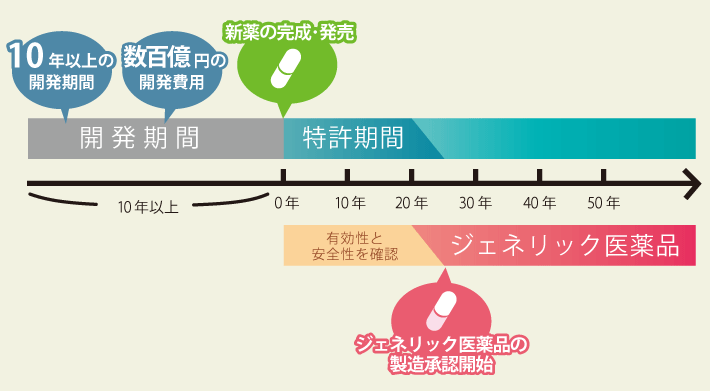
特許期間中に多くの患者さんに使用され、その有効成分の効能・効果や安全性が十分に確認されている新薬の特許満了後に、同じ有効成分で開発・製造されるお薬がジェネリック医薬品です。
ジェネリック医薬品も、新薬と同様に薬事法に基づく、さまざまな厳しい規制・基準を守って、開発・製造・発売されています。
特許期間中に多くの患者さんに使用され、その有効成分の効能・効果や安全性が十分に確認されている新薬の特許満了後に、同じ有効成分で開発・製造されるお薬がジェネリック医薬品です。
ジェネリック医薬品も、新薬と同様に薬事法に基づく、さまざまな厳しい規制・基準を守って、開発・製造・発売されています。

Point:開発期間3〜5年でできるジェネリック医薬品だからこそ安く提供できる。
薬についての市場調査・分析を行ったうえで、ジェネリック医薬品として製剤化するための研究を行います。10年以上、数百億円を投じて開発しても、新薬として認証されるのはごく僅かです。そんな開発コストが掛からない分、安心して利用できる薬を安く提供する事ができます。例に挙げた金額はあくまでも一例です。詳しくはかかりつけのお医者様や薬剤師さんにお尋ね下さい。
薬についての市場調査・分析を行ったうえで、ジェネリック医薬品として製剤化するための研究を行います。10年以上、数百億円を投じて開発しても、新薬として認証されるのはごく僅かです。そんな開発コストが掛からない分、安心して利用できる薬を安く提供する事ができます。例に挙げた金額はあくまでも一例です。詳しくはかかりつけのお医者様や薬剤師さんにお尋ね下さい。
ジェネリック医薬品は医師・薬剤師とご相談の上、お選び下さい。
2008年4月に処方せん様式が変わり、患者さんが、ジェネリック医薬品をさらに選択しやすくなりました。
ジェネリック医薬品への『変更不可』の欄に医師のサインがなければ、患者さんは薬剤師とご相談のうえ、ジェネリック医薬品をお選びいただけます。
医師に、「私のお薬はジェネリック医薬品に替えられますか?」とおたずねください。
ジェネリック医薬品への『変更不可』の欄に医師のサインがなければ、患者さんは薬剤師とご相談のうえ、ジェネリック医薬品をお選びいただけます。
医師に、「私のお薬はジェネリック医薬品に替えられますか?」とおたずねください。
Point:まずはお医者さん、薬剤師さんに相談。
いまや、医薬品を選ぶことに患者さんが参加する時代です。
ジェネリック医薬品を医師、薬剤師と一緒に選び、上手に使うことが、医療費負担を軽くする一歩 。
新薬の中には特許期間が満了していないものや、種類によってはジェネリック医薬品がなかったり、薬代が安くならないものもありますので、まずはご相談下さい。
いまや、医薬品を選ぶことに患者さんが参加する時代です。
ジェネリック医薬品を医師、薬剤師と一緒に選び、上手に使うことが、医療費負担を軽くする一歩 。
新薬の中には特許期間が満了していないものや、種類によってはジェネリック医薬品がなかったり、薬代が安くならないものもありますので、まずはご相談下さい。













新薬の開発には長い年月と莫大な費用がかかると言われています。
その新薬に比べ、ジェネリック医薬品は、既に有効性や安全性が確立されている医薬品を製造するため、開発に必要な時間や金額が少なくて済み、安価に製造することができるのです。
慢性的疾患でお薬を飲み続ける方など、患者さんの負担が大きいお薬代を減らすことができます。